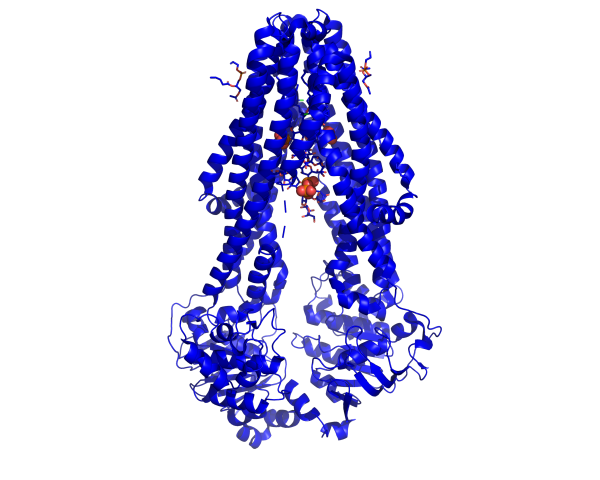
MsbA gehört zur Superfamilie der ATP abhängigen Membrantransporter. Die essenzielle Rolle im LPS Transport in E.coli, als auch die hohe Homologie zu P-Glykoprotein, einem humanen Exporter der die Blut-Hirn Schranke kontrolliert, machen es zu einem Ziel für strukturelle und funktionelle Forschung in Medizin und Pharmazie.
Während die Struktur von MsbA in geringer Auflösung gelöst wurde, bleibt der Mechanismus der Kopplung der ATP Bindung und Hydrolyse unklar. Neben biochemischer Charakterisierung nutzen wir biophysikalische Methoden wie die Fourier – Transform – Infrarot – und Fluoreszenzspektroskopie um diesen auf atomarer Ebene zu untersuchen.
Syberg et al. (2012) Time-resolved Fourier transform infrared spectroscopy of the nucleotide-binding domain from the ATP-binding Cassette transporter MsbA: ATP hydrolysis is the rate-limiting step in the catalytic cycle. J Biol Chem 287: 23923-23931
doi: 10.1074/jbc.M112.359208.
Rv1819c ist ein ABC-Transporter aus dem Tuberkulosekeim Mycobacterium tuberculosis. Basierend auf genetischen und mikrobiellen Tests ist es an der Aufnahme von Cobalamin beteiligt (Gopinath et al. - Open Biology, 2013). Da Tuberkulose nach wie vor schwierig zu behandeln ist, sind neue Angriffspunkte in wichtigen Stoffwechselwegen entscheidend für die Entwicklung wirksamer Medikamente.
Auf Basis einer kürzlich entdeckten niedrig aufgelösten Struktur von Rv1819c wurde postuliert, dass Rv1819c ein Mitglied eines neuen Typus von diffusionsvermittelnden ABC-Transportern ist (Rempel et al. - Nature, 2020). Während strukturelle Hinweise auf einen Tor-Mechanismus hindeuten, bleibt der molekulare Wirkmechanismus unklar. Neben der biochemischen Charakterisierung von rekombinant exprimiertem und aufgereinigtem Rv1819c untersuchen wir seine Struktur und Funktion mit biophysikalischen Methoden.